
肺癌在全世界范围内,都是一种备受临床和科研关注的恶性肿瘤。在过去的十年中,晚期非小细胞肺癌(NSCLC)的治疗取得了长足发展,特别是免疫检查点抑制剂(ICIs)的开发和应用,使得晚期NSCLC的五年生存率得到了极大的提高。目前,无论是单药还是联合,PD-1或PD-L1抑制剂已经成为了NSCLC一线或二线治疗的标准方案。但免疫治疗并非万能,其在临床使用中仍存在很多的挑战。例如,现有的疗效预测标志物并不能实现很精确的患者分层,免疫治疗失败的群体存在高度的异质性,如何找到耐药机制并开发更多更有效的预后标志物等。单细胞转录组测序技术(scRNA-seq)的快速发展和应用,正在逐渐揭开肿瘤复杂微环境的神秘面纱,为临床治疗带来了新的突破。
 2021年5月5日,Nature Communications杂志在线发表了由上海肺科医院周彩存教授团队和新格元生物合作的晚期非小细胞肺癌单细胞研究的重要成果“Single-Cell Profiling of Tumor Heterogeneity and Its Microenvironment in Advanced Non-small Cell Lung Cancer”。该研究基于新格元GEXSCOPE®单细胞测序技术全面解析了42例晚期NSCLC病人的穿刺样本,分别从肿瘤细胞异质性、基质和免疫细胞表型、浸润以及相互作用微环境等多个方面全面表征了晚期NSCLC患者的疾病特征。研究发现,不同患者来源的肿瘤在细胞组成、染色体结构、分化轨迹,以及胞间信号网络等方面都存在显著的异质性。该研究还首次发现了肿瘤异质性和肿瘤相关中性粒细胞之间的关联性,为中性粒在NSCLC中的功能研究和其在免疫治疗疗效中的潜在预测作用打开了新的视角。
2021年5月5日,Nature Communications杂志在线发表了由上海肺科医院周彩存教授团队和新格元生物合作的晚期非小细胞肺癌单细胞研究的重要成果“Single-Cell Profiling of Tumor Heterogeneity and Its Microenvironment in Advanced Non-small Cell Lung Cancer”。该研究基于新格元GEXSCOPE®单细胞测序技术全面解析了42例晚期NSCLC病人的穿刺样本,分别从肿瘤细胞异质性、基质和免疫细胞表型、浸润以及相互作用微环境等多个方面全面表征了晚期NSCLC患者的疾病特征。研究发现,不同患者来源的肿瘤在细胞组成、染色体结构、分化轨迹,以及胞间信号网络等方面都存在显著的异质性。该研究还首次发现了肿瘤异质性和肿瘤相关中性粒细胞之间的关联性,为中性粒在NSCLC中的功能研究和其在免疫治疗疗效中的潜在预测作用打开了新的视角。
突破:高质量晚期穿刺样本的保存和制备
肺癌微环境系统由不同细胞类型和一些非细胞物质所组成,这些成分通过复杂的相互作用,决定着肿瘤的发生发展以及对治疗的应答。虽然抗PD-1/PD-L1等免疫治疗在改善晚期NSCLC整体生存率上取得了一定的成功,但是在如何扩大获益人群、寻找更多治疗靶点以及疗效预测标志物等方面依然存在巨大的挑战。单细胞测序技术同时检测肿瘤异质性和免疫微环境,在早期的肺癌手术样本检测中已经获得过巨大的成功。但由于晚期NSCLC病人由于样本获取困难,现有的研究仍然十分缺乏。面对如此珍贵且取样困难的样本,如何高质量保存有限的穿刺样品并从中解离出满足单细胞测序研究所需要的单细胞悬液显得尤为关键。新格元采用自主研发的GEXSCOPE®组织保存液保存运输穿刺组织,进一步采用GEXSCOPE®组织解离液将组织解离成高活性的单细胞悬液。为了最大限度的获得足够数量的单细胞,通过不断的优化解离方法和时间,最终形成了可在15min内将肺穿刺组织解离成高质量单细胞悬液的解离方法。另外,肺穿刺组织常因出血含有大量红细胞,这也为制备高质量单细胞悬液带来了不小的挑战。为此,新格元采用GEXSCOPE®红细胞裂解液与细胞悬液按照一定比例混合,温和的裂解红细胞,使得红细胞完全裂解而对非红细胞活性影响较低,有效避免了红细胞污染的问题。
该研究纳入了大量的NSCLC样本(如图1a),涵盖了不同亚组,如腺癌和鳞癌、驱动基因突变型和野生型,为晚期肺癌穿刺样本提供了非常全面的微环境图谱和异质性分析,填补了已有肺癌相关研究中晚期NSCLC尤其鳞癌样本的空缺。对肺癌生态系统的全面了解、对改善临床的个性化治疗方案和预后评估都具有非常大的价值。

图1.研究纳入42例样本覆盖了亚型、分期、突变等状态。图片来源:Nature Communications
立足于精准的细胞注释
从组织到细胞的转化,是一个完整的单细胞解决方案非常关键的一步。新格元自有单细胞数据库平台SynEcoSysTM,可为不同物种的器官组织实现快速准确的细胞注释服务。该研究基于新格元数据库对90,406个细胞进行降维注释获得11种细胞类型,后续进一步细分为48种亚型,绝大部分亚型与已发表的肺癌文章鉴定的细胞类型结果一致。文章还特异地发现了部分罕见的免疫细胞亚型,如滤泡树突细胞(FDC)和Th17-like T细胞(图1b-e)。除了准确识别细胞类型,单细胞还能实现准确的NSCLC病理分型。研究发现,通过临床常用于区分腺癌和鳞癌的组化标志物(腺癌:TFF-1/NKX2-1和NAPSINA;鳞癌P40和CK5)所对应的基因在单细胞转录组层面的表达分布,大部分病人的病理类型判定结果与临床分型高度吻合。此外,该研究共同第一作者吴凤英教授还惊喜的发现,单细胞测序判定能协助临床病理分型(图2)。其中,一些在病理上判定为NSCLC-NOS的患者在肿瘤细胞层面有非常强的腺癌或者鳞癌的标志物表达,可以从基因层面协助分析。同时,单细胞可以明确描绘肿瘤细胞异质性,如一例腺癌混合肉瘤状癌的病例,也通过单细胞测序数据清楚展示出腺癌细胞和肉瘤样癌细胞异质性差异。

图2.腺癌和鳞癌临床标志物在单细胞转录组水平的精准分型。图片来源:Nature Communications
独创性、多维度解析肿瘤异质性助力临床标志物开发
为更深入全面地研究肿瘤异质性,该研究独创性地分别从单细胞转录组水平的拷贝数变异(CNA)和基因表达谱(GEP)两个层面去解析肿瘤的异质性分数,把患者分成LUADm(腺癌有突变)、LUADn(腺癌无突变)和LUSCn(鳞癌无突变)共三组分析,发现鳞癌的瘤内和瘤间异质性均整体高于肺腺癌,并且存在主克隆占比较低等现象。而晚期病人瘤内异质性要高于早期。研究揭示了肿瘤广泛的克隆性,以及基因型和表型间的关系,具有超越现有NSCLC分级系统的复杂性(图3)。

图3.肿瘤内和肿瘤间异质性分析。图片来源:Nature Communications
肿瘤的异质性和复杂性不限于肿瘤细胞,同时也体现在免疫细胞和基质细胞在表型和分布上。该文对T/NK细胞、B细胞、Myeloid、中性粒细胞、成纤维以及血管细胞都进行了亚型刻画和表征。比如,晚期肺癌浸润的CD8+T细胞中,上调多种免疫检查点的耗竭型T的浸润明显高于效应性T细胞;而巨噬细胞状态比传统的M1/M2分型更加复杂,通过趋化因子、胞外基质蛋白、干扰素响应等相关基因表达呈现不同促肿瘤功能。不同免疫细胞亚型的浸润特征、特异性上调的基因、以及亚型之间的相互作用,都与肿瘤表型和临床预后紧密关联。TCGA生存分析发现,树突细胞表达的朗格汉斯细胞特异性凝集素受体CD207在LUAD亚组中与预后存在一定相关性;特异性表达CXCL9 的巨噬细胞亚型在免疫治疗有效的患者中富集;巨噬细胞通过不同的免疫检查点通路抑制T细胞的功能,这些结果都为新治疗靶点或预后标志物的发现奠定基础。
研究发现,晚期NSCLC的肿瘤相关中性粒细胞表现出一定髓样抑制(MDSC)的特征,如表达人类多形核髓样抑制细胞(PMN-MDSC)的标志物LOX-1(OLR1),而LOX-1和前期研究报道的一些MDSC相关marker,如VEGFA、TGFB1、MMP9等在中性粒和其它髓系单核类细胞都存在选择性的表达,再次证明MDSC是一类高度异质性的群体。MDSC在癌症中具有重要临床意义,并且已成为肿瘤免疫学领域的研究热点。该文通过细胞组成和肿瘤亚型关联分析还发现,中性粒细胞在LUSC中浸润比例更高(图4),这一结论在其他肺癌研究中也得到过证实,并存在中性粒浸润受肿瘤内在驱动机制所调控的说法。然而,在LUAD病人中,中性粒和肿瘤细胞的互作强度更为显著,这些结果足以说明肿瘤中性粒的功能多样性和复杂性。已有研究分别显示,高中性粒细胞含量、瘤内高度异质性这两个因素是免疫治疗效果不好的独立因素,该研究结果也进一步证实了中性粒与瘤内异质性之间的关联,这些关联性都是未来免疫治疗疗效和诊断标志物的潜在突破点。

图4.中性粒细胞和肿瘤亚型、ITH的关联性分析。图片来源:Nature Communications
深入探究肿瘤微环境中各类细胞之间的相互作用能帮助我们更快地找到肿瘤发生发展、免疫抑制或免疫耐药的机制所在。例如肿瘤细胞通过趋化因子的表达招募免疫细胞进入肿瘤造成免疫抑制微环境;基质细胞也能表达一些生长因子促进肿瘤细胞生长或转移。该研究鉴定出了一类内皮出芽相关尖端细胞(tip cell),表达肿瘤血管新生转录组特征,通过CXCL12-CXCR4通路与肿瘤细胞完成互作;除此之外,大部分样本的肿瘤细胞通过VEGF-VEGFR信号通路与内皮进行信号传递。肿瘤相关成纤维则是通过PDGF和FGF等不同通路与肿瘤互作,并存在极强的病人间异质性。因此,VEGF和FGF类药物靶点对不同病人的适用性,可能需要更好的诊断标志物来进行指导。该研究还发现,晚期肺癌微环境中成纤维细胞存在比较明显的肌成纤维化状态,这种特征可能为临床肺癌的恶性诊断和预后评估提供新的标志物。
针对目前已上市和在研的各类免疫检查点药物靶点的基因表达及其引起的免疫抑制性微环境,该研究发现,肿瘤细胞与巨噬细胞通过不同的检查点通路抑制T细胞的功能,且巨噬细胞的抑制活性更为显著。不同亚组间的抑制性检查点通路也存在差异,例如,LUADm组样本表现出更高水平的TIGIT通路激活,TIM-3通路活性却低于其他组。研究者对部分晚期肺腺癌的公共数据进行了互作分析验证,也发现了相似的通路激活状态。这些治疗相关的互作通路在肿瘤间甚至同种亚型肿瘤内表现出的异质性再次提示我们,急需找到更精准的疗效标志物去提高晚期肺癌患者的生存率。
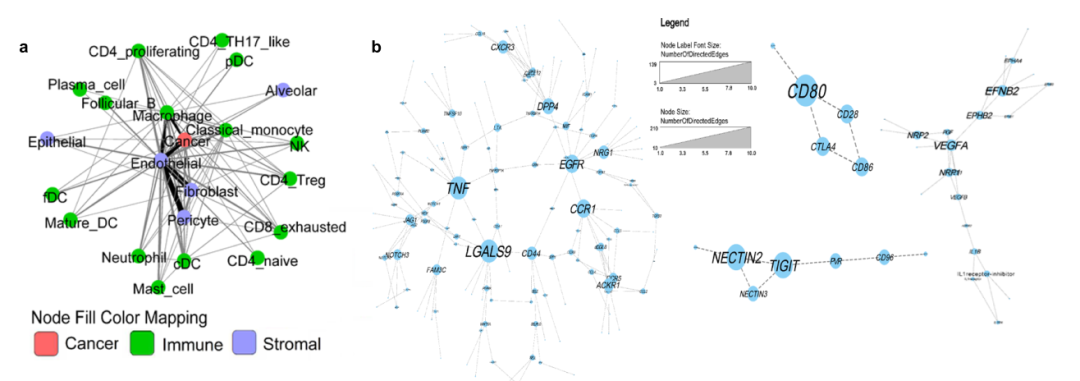

图5.细胞-基因互作网络。图片来源:Nature Communications
该文通讯作者上海肺科医院肿瘤科主任周彩存教授指出:
NSCLC患者在确诊时多已为晚期,治疗难度增加。近年来免疫治疗显著改善了这部分人群的预后,由原来不到5%的5年生存率显著延长近20%,但是免疫治疗仍存在很多挑战,如:如何扩大免疫治疗获益人群?如何预测原发或继发耐药?如何鉴别长期获益的人群?EGFR突变患者为何不能从抗PD-1/PD-L1治疗中获益?如何预测免疫治疗假性进展,快速进展?如何精准化免疫治疗等等诸多尚为解决的问题。单细胞测序的飞速发展无疑为这些悬而未决的问题提供了更多的可能性。单细胞测序可以精准捕获肿瘤异质性和其免疫微环境多层次、非常丰富的信息,未来对肺癌单细胞数据的深入挖掘,可以更好地实现患者分层,探索更多新的治疗靶点开发以及疗效预测标志物等,同时也为未来肿瘤精准医疗的全程管理和复发监测提供新的可能性。
新格元CEO方南博士表示:
很荣幸与上海肺科医院周主任团队的长期合作,也很高兴看到新格元的单细胞技术在攻克肺癌治疗难题这条道路上又取得了新的成绩。我们公司的产品和生信分析解决方案迄今已经成功用于1000多例肺癌样本,在疑难样本的单细胞测序以及数据的个性化分析及临床意义挖掘方面具有独特的优势。未来我们也会持续创新,致力于将突破性的单细胞分析技术应用于临床检测、健康管理和药物开发领域,为癌症患者带去更多希望。
本文由 SEQ.CN 作者:白云 发表,转载请注明来源!